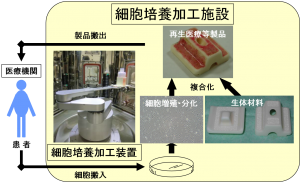
2014年11月に施行される再生医療新法では、細胞培養加工の医療機関から企業等への外部委託が可能となり、医薬品医療機器等法では、「再生医療等製品」が新たに定義され、条件付き早期承認制度が導入される予定である。再生医療の産業ベースでの実用化を促進するためには、再生医療等製品や周辺機器・装置の開発環境を整備する必要がある。現在、細胞培養加工プロセスは、クリーンルームが必要かつ、ほぼ全て手作業のため高コストとなることが課題となっている。この課題に対して、再生医療分野では、アイソレータの活用かつ自動化により、多様で柔軟な再生医療等製品の製造を低コストで実現する製造システムの完成に資するガイドラインの策定活動を実施している。
発行された医療機器等開発ガイドライン・報告書
関連する評価指標
| 2018/07/25 | ヒト(同種)表皮(皮膚)再生に関する評価指標 |
| 2018/03/20 | ヒト(自己)表皮(皮膚)再生に関する評価指標 |
| 2016/6/30 | ヒト(同種)iPS(様)細胞加工製品を用いた関節軟骨再生に関する評価指標 |
| 2016/6/30 | ヒト軟骨細胞又は体性幹細胞加工製品を用いた関節軟骨再生に関する評価指標 |
| 2015/9/25 | 鼻軟骨再生に関する評価指標 |
| 2014/9/12 | 同種iPS(様)細胞由来網膜色素上皮細胞に関する評価指標 |
| 2013/5/29 | 自己iPS 細胞由来網膜色素上皮細胞に関する評価指標 |
| 2011/12/7 | 歯周組織治療用細胞シートに関する評価指標 |
| 2010/12/15 | 関節軟骨再生に関する評価指標 |
| 2010/5/28 | 角膜内皮細胞シートに関する評価指標 |
| 2010/1/18 | 重症心不全細胞治療用細胞シートに関する評価指標 |
| 2010/1/18 | 角膜上皮細胞シートに関する評価指標 |